Rolianam@gmail.com
Actualmente han
sido identificados nueve herpesvirus equinos, de esos, los herpesvirus equinos
del tipo 1 al 5 se conoce que tienen la
capacidad de infectar caballos. El
herpesvirus equino tipo 1 (EHV-1) y tipo 4 (EHV-4) son los más importantes en
la industrial equina por su significancia económica y medica veterinaria. Ambos
virus son endémicos en las poblaciones de equinos domésticos en la gran mayoría
de países. El EHV-1 es el más importante de los dos tipos de virus ya que causa
una enfermedad multisíndrome conocida como Rinoneumonitis Equina. El termino
engloba un rango de síndromes: respiratorios, reproductivos (abortos),
neumonitis fatal en potros neonatos y mieloencefalitis (Timoney, 2011). Se piensa que el EHV-1 y el EHV-4 a
co-evolucionado con los caballos a lo largo de millones de años con lo que cada
uno ha adquirido la habilidad de establecer un estado de portador de toda la
vida en sus hospedadores naturales (Timoney, 2011).
De
los tres tipos de herpesvirus restantes que infectan caballos, ninguno tiene el
impacto clínico que poseen los tipos EHV-1 y EHV-4. El herpesvirus equino tipo
3 (EHV-3) es el causante del exantema coital equino, una enfermedad altamente
contagiosa, aunque relativamente benigna, no sistémica, venérea transmisible
(Timoney, 2011).
Los herpesvirus
equinos tipo 2 y tipo 5 son gammaherpesvirus que han sido asociados con un gran
número de entes en el caballo: enfermedades del tracto respiratorio superior e
inferior, queratoconjuntivitis, faringitis folicular crónica, y pobre desempeño
atlético. Un estudio reciente sugirió que una enfermedad pulmonar recientemente
descubierta, fibrosis pulmonar multinodular equina, se desarrolla en asociación
con el herpesvirus equino tipo 5 (Timoney, 2011).
1. Agente
Causal
Los herpesvirus equino 1 y 4 son
miembros del genero Varicellovirus, subfamilia
Alphaherpesvirusvirinae, familia Herpesviridae. Mientras que el
hospedador restringido del Herpesvirus equino tipo 4 (EHV-4) es el caballo, el
Herpesvirus equino tipo 1 (EHV-1) puede ocasionalmente infectar ganado,
ciervos, camélidos y ratones de laboratorio (Timoney, 2011). El EHV-4 y EHV-1
son Alfaherpesvirus de doble cadena entremezclada de ADN.
2. Epidemiologia
Ambos herpesvirus
(EHV-1 y EHV-4), son enzoóticos en muchas poblaciones de caballos domésticos.
Los virus se desenvuelven en un ciclo ecológico, el cual se desarrolla dentro
del caballo, en este se da una persistencia viral postinfección durante toda la
vida del animal (estado de latencia) en el cual el virus se encuentra protegido
del sistema inmune (Kydd et. al.,
2006). Los reservorios epizootiológicos para EHV-1 y EHV-4 son el gran y
globalmente distribuido pool de caballos infectados en estado de latencia, los
cuales son portadores y diseminadores intermitentes que pueden llegar a
infectar más de la mitad de la población equina de un criadero (Lunn et. al., 2009).
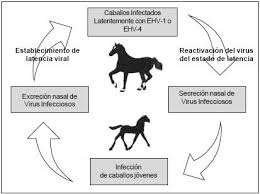
El ciclo
epizootiológico de vida de ambos herpesvirus es uno solo, el cual consta de
tres eventos repetitivos que amplifican y mantienen el reservorio del virus:
- Transmisión intergeneracional (vertical) del virus de la madre al potro
- Establecimiento del estado de latencia viral postinfección en potros afectado
- Reactivación y dispersión periódica del herpesvirus latente, resultando en una transmisión homo-generacional (horizontal) caballo-caballo.
El sitio de la
replicación viral primaria es el tracto respiratorio superior, donde, después
de la infección del epitelio nasal, el virus se vuelve intracelular y se
propaga muy rápidamente, infectando una amplia gama de tipos de células,
incluyendo las células endoteliales, linfocitos y células dendríticas (Kydd et. al., 2006). El virus infeccioso y el
antígeno vírico se pueden detectar en el ganglio linfático bronquial y otros
ganglios linfáticos asociados con el tracto respiratorio tan pronto como 12
horas después de la infección experimental con una cepa virulenta de EHV-1 que
demuestra la asociación íntima entre este virus y el sistema inmune durante la
fase aguda de la enfermedad (Kydd et.
al., 2006). La infección de los linfocitos por EHV-1 conduce al desarrollo
de una viremia asociada a la célula y este es responsable de la rápida difusión
de virus a sitios de replicación secundaria, incluyendo el útero preñado y la
médula espinal.
Mientras que la
enfermedad respiratoria es un inconveniente en un animal atlético y el tiempo
de entrenamiento se pierde mientras el animal se recupera, es la capacidad del
EHV-1 para provocar abortos durante la gestación tardía la que tiene el mayor
impacto económico (Kydd et. al.,
2006). El aborto puede ocurrir a los 5
meses de gestación, pero es más habitual entre los 8 meses. Los mecanismos de
aborto implican la infección de las células endoteliales y trombosis en el
útero gestante.
3. Transmisión
La mayoría de
caballos son infectados durante estados tempranos de vida, convirtiéndose luego
en reservorios epizootiológicos. Este ciclo es esencialmente silencioso, con la
mayoría de los eventos infecciosos subdiagnosticados como infecciones del
tracto respiratorio o con signos tan leves que causan poca alarma (Kydd et. al., 2006). Los recursos biológicos que pueden servir
como origen directo de infección natural para caballos susceptibles incluyen un
caballo infectado activo, el cual libera progenie viral en las secreciones
nasales; los fetos, membranas fetales o secreciones del tracto reproductivo de
una yegua, luego de esta haber abortado por EHV; y la reactivación endógena del
virus del estado latente en el caballo portador (Figura 1).
Transmisión del
virus EHV-4 (Timoney, 2011)
Los factores de
riesgo para tales brotes incluyen todas las situaciones que proporcionen estrés a los animales tales como
la sobrepoblación, alta carga parasitaria, pobre estado nutricional, climas
extremos, y la entrada de animales a diferentes grupos sociales ya establecidos
(Ruiz, 2006).
4. Signos
Clínicos
4.1. Enfermedad respiratoria
La enfermedad
respiratoria está caracterizada por fiebre, letargia, anorexia, linfadenopatía
submandibular y descarga nasal profusa, la cual puede llegar a ser
mucopurulenta, rinofaringitis y traqueobronquitis; también es posible encontrar
conjuntivitis moderada manifestada por la presencia de secreción ocular (Harless y Pusterla, 2006). El cambio a una secreción
mucopurulenta es el resultado de una infección bacteriana secundaria causada
por Streptococcus zooepidemicus. La
descarga está acompañada por tos esporádica. Esta infección es debida a una
disminución de la respuesta inmune del animal provocada por el virus o por condiciones
externas (Timoney, 2011).
El virus puede
alojarse en los pulmones generalmente en animales jóvenes y provocar una
bronconeumonía exacerbada por la infección bacteriana secundaria con signos de
enfermedad respiratoria del tracto bajo como tos, sonidos anormales a la
auscultación e incremento en el esfuerzo inspiratorio (Harless y Pusterla, 2006). En los animales adultos que han estado
expuestos a EHV-4 en numerosas ocasiones, los signos clínicos son mínimos, la
infección conlleva una reducción en el nivel de productividad del animal,
causada por una infección inaparente en el tracto respiratorio alto y bajo (Harless y Pusterla, 2006).
4.2.
Aborto
El más relacionado
con episodios de aborto es el EHV-1, el cual causa aborto en yeguas que no
muestran ningún signo clínico de enfermedad. Estas generalmente abortan entre
los 6 y 11 meses de gestación. El aborto antes de los 5 meses de gestación es
raro debido al largo periodo de incubación (9 a 121 días) que requiere el virus
(Sadlier, 2011; Timoney, 2011). Los tejidos de los potros abortados poseen un
amplio rango de lesiones macroscópicas y microscópicas, en los abortos que
ocurren a los 6 meses los fetos se encuentran autolisados. En abortos tardíos
(luego de 7 meses) hay focos necróticos visibles en aproximadamente el 25% de
los casos, en hígado, bazo, pulmones y glándulas adrenales (Timoney,
2011).
Los fetos abortados,
además de los signos de infección multisistémica presentan altos títulos
virales confirmables por el laboratorio. Se han reportado algunas yeguas que
abortan luego de 14 a 120 días de la exposición al virus, sin presentar ningún
signo clínico. Sin embargo, si la
infección por EHV-1 es seguida por un
estado de latencia viral, podría abortar meses o años después de la infección
primaria (Harless y Pusterla, 2006).
4.3. Muerte
neonatal de potros
Algunos fetos
infectados en una etapa terminal de la preñez, pueden nacer vivos y a término,
pero enferman al nacimiento o en días siguientes. Los potros se encuentran
débiles y requieren cuidados, se presentan letárgicos, piréticos, hipoxémicos y
exhiben fuertes deficiencias respiratorias (Ruiz, 2006). El deterioro clínico
en estos potros infectados in útero por EHV-1, ocurre rápidamente y el
pronóstico siempre es grave.
La mortalidad en estos potros infectados congénitamente
es del 100%, debido a una neumonía viral, la cual lleva a una falla respiratoria
en unos pocos días. Los potros son altamente susceptibles a las infecciones
bacterianas secundarias. La infección congénita por EHV-1 puede ser epizoótica
y puede estar relacionada con brotes de abortos por EHV-1. En contraste,
raramente se ha asociado a EHV-4 como causa de enfermedad neonatal en potros (Sadlier,
2011; Timoney, 2011).
4.4. Mieloencefalopatía
 La mieloencefalitis por herpesvirus es una
enfermedad poco común pero devastadora. Se han identificado casos aislados de
enfermedad neurológica por EHV-4, pero se presenta generalmente por EHV-1 (Pronost
et. al, 2013). El intervalo entre la
infección inicial del tracto respiratorio y la presentación de los signos
neurológicos es de 6 a 10 días (Timoney, 2011). Se presenta principalmente en animales adultos
y sus signos neurológicos son variables, pudiendo ser simétricos o asimétricos.
La manifestación más común de la enfermedad es la ataxia de los miembros
posteriores, la cual progresa hasta la recumbencia (Pronost et. al, 2013). Algunos caballos pueden
presentar parálisis de la pared o el esfínter de la vejiga, lo cual conlleva a
una incontinencia urinaria; algunos pueden presentar inclinación de la cabeza.
La mieloencefalitis por herpesvirus es una
enfermedad poco común pero devastadora. Se han identificado casos aislados de
enfermedad neurológica por EHV-4, pero se presenta generalmente por EHV-1 (Pronost
et. al, 2013). El intervalo entre la
infección inicial del tracto respiratorio y la presentación de los signos
neurológicos es de 6 a 10 días (Timoney, 2011). Se presenta principalmente en animales adultos
y sus signos neurológicos son variables, pudiendo ser simétricos o asimétricos.
La manifestación más común de la enfermedad es la ataxia de los miembros
posteriores, la cual progresa hasta la recumbencia (Pronost et. al, 2013). Algunos caballos pueden
presentar parálisis de la pared o el esfínter de la vejiga, lo cual conlleva a
una incontinencia urinaria; algunos pueden presentar inclinación de la cabeza.
El déficit neuronal resulta de una vasculitis
isquémica acompañada de trombosis dentro de los pequeños vasos sanguíneos del
sistema nervioso central. Los signos nerviosos aparecen repentinamente,
aumentando su intensidad a los 2 ó 3 días y generalmente no son progresivos. El
pronóstico de los caballos no recumbentes es favorable, pero es pobre para los
animales que permanezcan con sintomatología por más de 2 días (Pronost et. al, 2013).
5. Patogénesis
5.1. Enfermedad
respiratoria
La rinoneumonitis
equina causada por EHV-4 raramente es fatal. La muerte neonatal de potros es
consecuencia del aumento de la viremia, la dispersión de focos de necrosis en
muchos tejidos y órganos, y de neumonía. El número de infecciones fatales
aumenta cuando los anticuerpos maternales transferidos al potro son
insuficientes o ausentes, y cuando se presentan infecciones bacterianas
secundarias. La neumonía es un hallazgo común en estos potros (Harless y Pusterla, 2006).
Después de la
infección vía intranasal o por aerosoles, los caballos jóvenes desarrollan
distintas lesiones herpéticas en las membranas mucosas a través de todo el
tracto respiratorio superior. Hay necrosis del epitelio respiratorio y los
centros linfoides germinales, además se puede demostrar la presencia de cuerpos
de inclusión intranucleares. Luego de una reinfección, los caballos jóvenes
desarrollan una hiperplasia linfoide caracterizada por numerosas figuras mitóticas
(Harless y Pusterla, 2006).
5.2. Aborto
La ruta natural de
infección por EHV-1 es a través del tracto respiratorio superior, seguida por
una viremia asociada a células (linfocitos), resultando en una infección
placentaria e infección del feto con subsecuente aborto (Sadlier, 2011). Los
fetos abortados antes de los 6 meses de gestación se encuentran autolisados, es
posible encontrar inclusiones intranucleares en células de todo el cuerpo, sin
una respuesta inflamatoria celular local (Timoney, 2011). En contraste, las lesiones observadas en los
abortos tardíos pueden incluir petequias visibles en las membranas mucosas,
edema subcutáneo, exceso de fluido pleural, edema pulmonar, agrandamiento del
bazo con prominencia de folículos linfoides y focos de necrosis hepática de un
color crema. Las características microscópicas de las lesiones incluyen
bronquiolitis, neumonitis, necrosis severa de la pulpa blanca del bazo y
necrosis hepática focal acompañada de una fuerte respuesta inflamatoria
celular.
Las lesiones en
los fetos abortados en etapa temprana de gestación con ausencia de la respuesta
inflamatoria celular sugieren la ausencia de respuestas celulares
inmunológicas. En contraste, los fetos abortados en estados tardíos, muestran
características de respuesta celular. Esto se puede explicar, pues se conoce
que el sistema inmune del feto equino es capaz de responder a antígenos
específicos a partir de los 7 meses de gestación (Timoney, 2011).
Los hallazgos microscópicos en el útero varían
de un estado normal, a la presencia de un bajo grado de infiltración
perivascular con fuerte infiltración de eosinófilos en el tejido conectivo
interglandular del útero. Además, hay completa separación del alantocórion y
del endometrio uterino. Un estudio de la patogénesis del aborto por EHV-1
demostró que se podía encontrar DNA viral en detritos celulares dentro de las
glándulas endometriales y que estos se difunden a través de la placenta a
sitios de infarto microcotidelonario; también se ha podido evidenciar la
presencia in vivo del genoma viral en los trofoblastos, sugiriendo una
diseminación célula-célula, desde las células endometriales hacia las trofoblásticas
(Sadlier, 2011).
5.3. Muerte
neonatal de potros
Las principales
lesiones involucran el tracto respiratorio. Los pulmones se encuentran
voluminosos y firmes, generalmente de un color “púrpura”, con atelectasis
masiva. Se pueden encontrar estriaciones hemorrágicas en la submucosa a lo
largo de la tráquea y los bronquios mayores. Los nódulos linfoides bronquiales
pueden estar alargados, congestionados y edematosos. Las lesiones microscópicas
incluyen alveolitis histiocítica no supurativa y media a severa bronquitis
necrotizante focal y/o bronquiolitis con inclusiones intracelulares
eosinofílicas (Sadlier, 2011). Siempre se encuentran inclusiones intranucleares
en los pulmones, frecuentemente en el timo, raramente en el hígado y nunca han
sido identificadas en el bazo o glándula adrenal (Sadlier, 2011).
La infección
neonatal por EHV-1 causa neumonitis con disminución y/o degeneración de los
linfocitos del timo y bazo, la cual facilita las letales infecciones
bacterianas secundarias. Estos potros tienen la tendencia a tener un conteo
total de células blancas bajo y a encontrarse relativamente ictéricos (Timoney,
2011).
5.4. Mieloencefalitis
El hallazgo
histopatológico de mayor importancia en la mieloencefalitis por EHV es una
vasculitis con degeneración hipóxica secundaria en el tejido neural adyacente.
Los cambios vasculares son generalmente más prominentes en la médula espinal que
en el cerebro, mostrando una necrosis hemorrágica espinal, y las lesiones en la
materia blanca de la médula espinal son más prominentes que las de la materia
gris (Pronost et. al, 2013).
Durante la viremia
asociada a células, en presencia de altos títulos de anticuerpos, el virus
puede dispersarse de las células infectadas circulantes directamente a las
células endoteliales, contagiando así a estas sin una fase extracelular. Una vez iniciada la infección endotelial,
esta puede diseminarse a través de las células del parénquima adyacente. Esto
podría llevar a una severa y generalizada vasculitis sin destrucción neuronal
primaria (Pronost et. al, 2013).
También se ha sugerido que las lesiones
vasculares por EHV-1 son debidas a reacciones inmunológicas específicas para
EHV-1 en el endotelio vascular, pues se ha reportado un incremento de cuatro
veces los títulos de anticuerpos en caballos con mieloencefalitis por EHV-1 que
en caballos expuestos al virus pero sin la enfermedad clínica (Timoney, 2011).
6. Métodos
Diagnósticos
La identificación
del agente se puede realizar por diversos métodos, entre estos algunos
directos, encaminados a evidenciar la presencia viral, y otros indirectos, los
cuales evidencian la presencia de anticuerpos circulantes contra la entidad.
Los segundos no son muy útiles en lugares en los cuales se lleva un régimen de
vacunación, pues no es posible diferenciar anticuerpos postvacunales de
anticuerpos postinfección.
El diagnostico de
aborto por herpesvirus equino está basado sobre la presencia de las lesiones
patológicas características del feto y placenta, detección del virus por aislamiento en
cultivo celular y/o PCR, y la demostración del antígeno viral en la placenta y
el tejido fetal congelado o fijado en formol por inmunofluorescencia o tinción
de inmunoperoxidasa indirecta (Timoney, 2011)
El diagnóstico en
campo para ayudar a diferenciar los abortos por herpesvirus equino de aquellos
causados por arteritis viral equina, es el hecho de que en la infección por
este último, la yegua puede haber exhibido signos clínicos de arteritis equina
viral antes de abortar. Además, los fetos infectados con el virus de la
arteritis viral equina, muy rara vez muestran lesiones macroscópicas, en
contraste con los infectados con EHV-1 y EHV-4, que exhiben una gama más
frecuentes de lesiones fuertemente indicativa de esta infección (Sadlier,
2011).
6.1.
Identificación del Agente
Los métodos de
diagnóstico rápido son importantes debido a que la enfermedad es muy contagiosa
y puede generar brotes explosivos con una mortalidad elevada a causa de las
secuelas neurológicas y del aborto (OIE, 2012). Aunque recientemente se han
descrito varias técnicas de diagnóstico nuevas y rápidas, basadas en el
enzimoinmunoensayo (ELISA), la reacción en cadena de la polimerasa (PCR), la
tinción inmunohistológica con peroxidasa, o las sondas de hibridación con
ácidos nucleicos, su uso suele estar limitado a los laboratorios especializados
de referencia, y el método elegido para el diagnóstico de la rinoneumonitis en
los laboratorios diagnósticos de virología que manejan continuamente muchas
muestras continúa siendo la metodología tradicional del aislamiento en cultivo
celular seguido por la identificación de los virus aislados (OIE, 2012). El
aislamiento eficaz del EHV-1/4 en el laboratorio depende del seguimiento
estricto de ciertos métodos relativos a la toma de muestras y a su procesamiento
en el laboratorio.
6.1.1. Toma de
Muestras
Las mejores
muestras para el aislamiento del virus son los exudados nasofaríngeos de los
caballos en los estados febriles más precoces de la enfermedad respiratoria, y
se toman por vía nasal mediante frotis del área nasofaríngea. Después de la
toma del frotis se transporta inmediatamente al laboratorio de virología en 3
ml de medio líquido muy frío (pero no helado) (MEM [medio mínimo esencial]
libre de suero y con antibióticos). La infectividad de los virus se puede
prolongar mediante la adición de seroalbúmina bovina o de gelatina al 0,1%
(p/v) (OIE, 2012).
El examen vírico
de los tejidos fetales en el caso del aborto sospechoso por EHV tiene mayor
eficacia diagnóstica cuando se lleva a cabo en muestras tomadas asépticamente
del hígado, los pulmones, el timo y el bazo. Las muestras tisulares deben
transportarse al laboratorio y mantenerse a 4°C hasta su inoculación en
cultivos de tejidos. Las muestras que no puedan procesarse en unas horas deben
guardarse a –70°C. En los casos ante mórtem de enfermedad neurológica por el
EHV-1, el virus puede aislarse a menudo de la fracción de leucocitos de la
sangre de los caballos con infección aguda o, con menor frecuencia, de la
nasofaringe del animal afectado o de los animales de compañía (OIE, 2012).
6.1.2. Aislamiento
del virus
Para un
aislamiento primario eficaz del EHV-1/4 de los caballos con enfermedad
respiratoria, se deben utilizar cultivos celulares de origen equino. Tanto el
EHV-1 como el EHV-4 se pueden aislar de muestras nasofaríngeas utilizando
células primarias de riñón fetal equino o líneas celulares de fibroblastos
equinos derivados de tejido dérmico o pulmonar. Mediante incubación a 37°C en
una plataforma circular durante 1,5–2 horas, se permite que el virus se una a
la monocapa inoculada. Se deben incubar en paralelo monocapas de células
control no inoculadas que contengan solo un medio de transporte estéril. Los recipientes inoculados deben examinarse a
diario al microscopio para observar la aparición del efecto citopático (ECP)
característico de los herpesvirus (redondeamiento focalizado, aumento de la
refractabilidad, y separación de las células) (OIE, 2012).
Para el
aislamiento del HEV-1 de los tejidos de fetos abortados o de casos post mórtem
de la enfermedad neurológica, se pueden utilizar varios tipos celulares (por
ejemplo, riñón de conejo [RK-13], riñón de hamster neonato [BHK-21], riñón
bovino de Madin–Darby [MDBK], riñón de cerdo [PK-15], etc.), pero los cultivos
de células de origen equino son más sensibles y deben utilizarse si se desea
detectar los casos infrecuentes de aborto por el EHV-4. Igualmente, puede
intentarse el cultivo de leucocitos sanguíneos periféricos para detectar la
presencia del EHV-1 tiene con frecuencia éxito en caballos en la fase inicial
de la mieloencefalopatía (OIE, 2012).
6.1.3. Detección
del Virus por Inmunofluorescencia Directa
La detección de
antígenos de EHV-1 por inmunofluorescencia directa en muestras de tejido post
mórtem de fetos equinos abortados supone un método indispensable en el
laboratorio de diagnóstico veterinario para hacer un rápido diagnóstico
preliminar de aborto por herpesvirus (OIE, 2012). Las muestras provenientes de
una disección reciente de tejido fetal se congelan, se seccionan en un
criostato a –20°C, se montan en portas para microscopía y se fijan con acetona
al 100%. Después de secar, se incuban los cortes a 37°C durante 30 minutos en
una atmósfera húmeda con una dilución apropiada de anticuerpo de cerdo
conjugado frente al EHV-1. El exceso de los anticuerpos no reaccionantes se
elimina con dos lavados en PBS y, a continuación, los cortes de tejido se
cubren con un medio de montaje acuoso y un cubreobjetos, y se observa para la
presencia de células fluorescentes que indican la presencia de antígeno del
EHV. Cada prueba debe incluir un control positivo y negativo con cortes de
tejidos fetales infectados y no infectados por EHV-1, respectivamente.
6.1.4. Detección
del Virus por Tinción con Inmunoperoxidasa
Los métodos inmunohistoquímicos
de tinción enzimática se han desarrollado recientemente como procedimientos
para detectar antígeno del EHV-1 en tejidos de fetos equinos abortados o de
caballos con afección neurológica incluidos en parafina. La tinción
inmunoenzimática del EHV-1 es particularmente útil para la evaluación
simultánea de las lesiones morfológicas y la identificación del agente
infeccioso. También se puede realizar la tinción con inmunoperoxidasa para
EHV-1 o EHV-4 sobre monocapas de células infectadas. En cada prueba de
inmunoperoxidasa deben incluirse controles adecuados para considerar tanto la
especificidad del método como la especificidad del anticuerpo.
6.1.5. Detección
del Virus por PCR
La PCR se puede
utilizar para una rápida amplificación y detección diagnóstica de los ácidos
nucleicos del EHV-1 y el EHV-4 en muestras clínicas, tejidos conservados
incluidos en parafina o cultivos celulares inoculados. Se ha diseñado una
variedad de cebadores específicos de cada tipo para distinguir entre la presencia
del EHV-1 y del EHV-4. El diagnóstico de la enfermedad por la PCR es rápido,
sensible, y no depende de la presencia de virus infecciosos en la muestra
clínica
Para el
diagnóstico de las infecciones activas por el EHV, los métodos de la PCR son más
fiables con muestras de fetos abortados o con frotis nasofaríngeos y leucocitos
de sangre periférica de potros y caballos de un año; son más útiles en
epizootias explosivas de abortos o enfermedades del tracto respiratorio en las
que una rápida identificación del virus puede ser un factor determinante para
aplicar estrategias de control (OIE, 2012).
Es de gran ventaja
para guiar la planificación e implementación de estrategias apropiadas para el
control de brotes de mieloencefalitis equina causada por EHV-1, contar con
ensayos de PCR a tiempo real que no solo confirman la presencia del virus sino
que también determina si los individuos están infectados de cepas salvajes o
mutantes (neuropatógenicas) del virus (Timoney, 2011). La detección de virus EHV-1 o EHV-4 latente
no es posible con métodos de diagnóstico clásicos para estas infecciones. En el
animal vivo, la detección de EHV-1 latente en los leucocitos de sangre
periférica se puede intentar usando la detección por PCR del gen del tránscrito
asociado a latencia (LAT).
6.1.6.
Histopatología
El examen
histopatológico de las secciones de muestras de tejidos fijadas con formalina e
incluidas en parafina, procedentes de fetos abortados o de caballos con
afecciones neurológicas, es una parte esencial del diagnóstico de laboratorio
de estas dos manifestaciones clínicas de la enfermedad. En los fetos de los
abortos, las lesiones patológicas del EHV-1 son los típicos cuerpos de
inclusión intranucleares de las infecciones herpéticas en el epitelio bronquial
o en las células periféricas de las áreas de necrosis hepáticas.
La lesión microscópica característica que se
asocia con la neuropatía por el EHV-1, aunque no es patognomónica, es una
vasculitis trombótica degenerativa de los pequeños vasos sanguíneos del cerebro
o la médula espinal (desgarro perivascular e infiltración por células
inflamatorias, proliferación endotelial y necrosis, y formación de trombos)
(OIE, 2012).
7.
Tratamiento
No existe ningún tratamiento
específico disponible actualmente para la rinoneumonitis equina. Los fármacos no esteroidales pueden ser
administrados para controlar la inflamación y fiebre. Así mismo, los
antibióticos se pueden indicar en caballos con descargas nasales
mucopurulentas. Se debe garantizar el reposo de los animales afectados y
tratamiento de soporte.
8. Prevención
y Control
El programa de prevención y
control de la rinoneumonitis equina está basado en un plan de vacunación
profiláctico enfocado a incrementar la inmunidad contra el EHV-1 y EHV-4 en la
población animal. La vacunación para
yeguas preñadas debe realizarse en el 5to, 7mo y 9no mes de gestación para
proveer protección en los meses donde el feto es más susceptible a la infección
viral. La vacunación a los potros debe comenzarse con una primovacunación a los
4-6 meses de edad, seguido de una segunda vacunación 4-6 semanas posterior a la
primera administración y por ultimo una tercera aplicación a los 10-12 meses de
edad (Timoney, 2011). Se recomienda la
revacunación cada 4 meses de intervalo.
Se
dispone de vacunas vivas atenuadas y de vacunas inactivadas como productos
autorizados y preparados para la utilización comercial como ayuda profiláctica
en la reducción de los casos de enfermedad causada por la infección con los
EHV-1/4. La experiencia clínica ha demostrado que ninguna de las preparaciones
de vacuna proporciona un grado absoluto de protección contra la enfermedad. Los
fabricantes respectivos recomiendan dosis múltiples, con la repetición anual,
de las vacunas contra la rinoneumonitis equina comercializadas en la
actualidad, con cronologías de vacunación que varían dependiendo de la vacuna
en particular.
Las
prácticas a ejecutarse durante los brotes de infección por EHV-1/4 apuntan a
reducir la diseminación de aerosoles infecciosos, el contacto directo, y
fómites contaminados, así como, a reducir el estrés inducido por la infección
latente. Implementar prácticas de aislamiento, cuarentena y desinfección son
claves importantes para el control de la enfermedad. Si se presentan síntomas
respiratorios sugestivos de infección por EHV-1/4, al igual que abortos
sospechosos por rinoneumonitis, se debe aislar a los animales afectados con
prontitud y por completo del resto de la ejemplares.
Tomado de:
1. Gardiner, W. y et. al. 2012. Strain impact on equine
herpesvirus type 1 (EHV-1) abortion models: Viral loads in fetal and placental
tissues and foals. Revista Vaccine. Numero 30. Páginas 6564– 6572
2. Harless, W. Pusterla, N. 2006. Equine Herpesvirus 1 and 4 Respiratory
Disease in the Horse. Clinical Techique in Equine Practice. Volumen 5.
Páginas 197-202
3. Kydd, J. Townsend, H. Hannant, D. 2006. The equine immune response to equine
herpesvirus-1: The virus and its vaccines. Veterinary Immunology and
Immunopathology. Volumen 111. Páginas 15–30.
4. Pronost, S. y et. al. 2013.
Equine Herpesvirus Myeloencephalopathy: an update on EHV-1. Proceeding del 13vo Congreso Internacional de
la Asociación Veterinaria Equina. Budapest, Hungría. Octubre, 03 – 05.
5. Ruiz,
J. 2006. Rinoneumonitis Equina: un riesgo para la cría y la salud de la
población equina colombiana. Revista Colombiana de Ciencias Pecuarias. Volumen
7. Numero 2. Medellín, Colombia.
7. Sadlier,
M. 2011. Herpesvirus Abortion and Perinatal Mortality. Proceeding del 50vo
Congreso de la Asociación Británica Veterinaria Equina. Liverpool, Reino Unido.
Septiembre, 07-09, 2011.
8. Timoney, P. 2011. Equine
Herpesviruses. En: Mckinnon A, Squires E, Vaala W, Varner D (eds.). Equine
Reproduction. Editorial Wiley-blackwell. Segunda edición. Volumen 2. Ames,
Iowa, Estados Unidos de América. 2011. Página 2376 - 2390.
9. Versión
adoptada de la Asamblea Mundial de Delegados de la OIE. 2012. Rinoneumonitis
Equina (En línea). Accesado el 19/06/2014. En: http://web.oie.int/esp/normes/mmanual/pdf_es/2.5.07_Rinoneumonitis_equina.pf




.JPG)


No hay comentarios:
Publicar un comentario